過去の新着情報
今年のノーベル賞(生理学・医学賞)を、大阪大学の坂口志文特任教授が受賞されました。ほかにも、米国システム生物学研究所のメアリー・ブランコウさんと、米ソノマ・バイオセラピューティクスのフレッド・ラムズデルさんのお二人が坂口先生とともに受賞されています。
3人が研究しているのが、免疫が細胞を区別し、外敵の病原体だけを攻撃する仕組みについてです。そして、「制御性T細胞」という免疫細胞を発見しました。この制御性T細胞、今回のニュースで初めて耳にしたという方も多いと思いますが、実はがん治療の分野では近年注目されていた細胞でした。
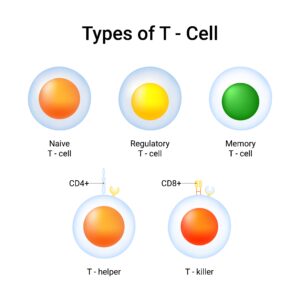
免疫細胞は、私たちの体を細菌やウイルス、がん細胞を攻撃してなどから守ってくれていますが、ときに誤って自分の正常な細胞や組織を攻撃してしまうことがあります。その結果、自己免疫疾患という病気(関節リウマチや潰瘍性大腸炎、1型糖尿病など)を発症してしまいます。
そこで、免疫には、悪者である細菌などを攻撃する働きだけでなく、自分の体を誤って攻撃しないようにブレーキをかける仕組みがあります。その役割を果たしているのが「制御性T細胞」です。名前のとおり、免疫が暴走しないよう「制御」しているんですね。
ところが、がん患者さんの場合は、この制御性T細胞ががんに対する免疫反応を抑えてしまうため、制御性T細胞の数を減らすための研究が行われているのです。
免疫細胞療法を実施している医療機関の中には、患者さんの体内で制御性T細胞がバランス的に多くなりすぎていないかを調べる「免疫機能検査」を行っているところがあります。
制御性T細胞とは?がん免疫とαβT細胞療法 の関係を解説
ブレーキが効きすぎている場合には、攻撃を担う「キラーT細胞」を増やし、制御性T細胞を抑えるαβT細胞療法を行います。これにより、免疫サイクルをしっかり回して、体が本来持っている免疫の力を引き出すことが可能になります
がん治療においても自分の免疫の状態を調べて把握し、その結果に基づいて治療方針を決めることが大切です。
免疫の仕組みは複雑ですが、こうした研究者の方々の努力により大きく進歩しています。

2025年3月に行われた「日本再生医療学会」の総会で、エビデンスや診療の質に乏しい再生医療が広がっている問題を解決するために、新たな取り組みが発表されました。
患者さん自身の免疫細胞を機能強化するがん免疫細胞治療も、日本では再生医療の位置づけで、多くの医療機関で自由診療として行われています。しかしながら、安全性を確認する方法や手順が一律には定められていないため、提供する医療機関によってその質がまちまちです。
2024年には都内のあるクリニックで免疫細胞治療を受けた患者さんが敗血症になって入院し、厚生労働省は管理者の医師などに改善命令を出すといったことも起こりました。治療に使う細胞を加工する施設などで、細菌が混入した可能性があるとされています。
また、医療において「エビデンス(科学的根拠)」はとても重要です。エビデンスがしっかりある治療は、多くの研究や実験を経て、その安全性や効果が証明されます。日本の自由診療の再生医療には、十分なエビデンスがないまま提供されているものが少なくないことも指摘されています。
こうした問題を解決するために、日本再生医療学会は「YOKOHAMA宣言2025」を公表しました。
この宣言では、自由診療の再生医療を以下の2つに分けることを提案しています。
1)検証型診療(エビデンスをしっかり確認する診療)
・科学的なデータをもとに、安全性や効果を確認する
・透明性が高く、第三者が検証できる
・国際基準に合った治療
2)無検証診療(エビデンスが不十分な診療)
・データに基づいた安全性、効果の確認を実施しない
・データの公開がなく、第三者が検証できない
・リスクの説明が不十分
・専門知識のない医師が提供している
・患者の利益よりも、利益追求が優先されている
学会は、今後「検証型診療」と認められた治療を公表し、無検証診療を抑制する仕組みを作っていく方針です。
この動きが進めば、患者は「どの治療が信頼できるのか?」を見極めやすくなり、安心して治療を受けられる環境を整えるための大きな一歩と言えます。
再生医療・細胞医療は、正しく提供されれば可能性のある治療法です。
だからこそ、安全で信頼できる治療が広まる環境整備を速やかに行ってほしいと思います。
【参考】
日本再生医療学会ホームページ https://www.jsrm.jp/news/news-16112/
日経メディカル記事 https://medical.nikkeibp.co.jp/leaf/mem/pub/hotnews/int/202503/588044.html
いつもご覧いただきありがとうございます。 免疫の力でがんを治す患者の会事務局です。
12月に放送された再生医療の最前線を紹介するテレビ番組(BS朝日)で、免疫細胞治療が取り上げられましたが、その再放送があるようです。
BS朝日放送
2月22日(土)午後2時~ 再放送予定
2月22日(土)午後2時30分~ 見逃し配信予定(1ヶ月間)

日々進歩している再生医療の研究や実際の診療を取り上げており、免疫細胞を用いたがん免疫細胞治療のほかにも、幹細胞を用いた関節治療や乳房再建治療について、専門の医師や治療経験者が詳しく話されています。
BS朝日番組公式ページ
https://www.bs-asahi.co.jp/saiseiiryo/
いつもご覧いただきありがとうございます。 免疫の力でがんを治す患者の会事務局です。
再生医療の最前線を紹介するテレビ番組で、免疫細胞治療が取り上げられています。
日々進歩している再生医療の研究や実際の診療を取り上げており、免疫細胞を用いたがん免疫細胞治療のほかにも、幹細胞を用いた関節治療や乳房再建治療について、専門の医師や治療経験者が詳しく話されています。
番組放送は既に終了しているようですが、見逃し配信やYouTubeで視聴できます。

BS朝日動画ページ
https://www.bs-asahi.co.jp/saiseiiryo/
ChatGPTを使って番組の内容を文字起こし、要約してみました。
ChatGPTは本当に便利ですね。
治療検討されている方に参考になれば幸いです。
(全編を文字起こしすると膨大になるので、詳しくご覧になりたい方は動画で見ていただくのがよいと思います)
【がん免疫細胞治療部分の要約】
がん治療は大きく分けて、特定の部位を対象とする局所治療と、体全体に作用する全身治療の2種類があります。
局所治療には手術や放射線療法があり、がんが特定の臓器にとどまっている場合には有効ですが、転移がんには対応できないという課題があります。一方、全身治療は体全体に効果を及ぼす治療法で、抗がん剤や免疫療法がその代表です。
抗がん剤はがん細胞を直接攻撃する効果が高いものの、正常細胞にもダメージを与えるため副作用が強く、これに対し免疫療法は体の免疫機能を活用し、副作用が少ないというメリットがありますが、効果が現れるまでに時間がかかる傾向があります。
免疫細胞治療は、患者自身の免疫細胞を利用する治療法で、体外で免疫細胞を増殖・強化してから再び体内に戻すことで、免疫力を高めがんを抑えます。代表的な免疫細胞にはT細胞やNK細胞があり、これらの細胞を強化することで治療効果を高める仕組みです。患者の体に優しいメリットがある一方、短期間でがんを縮小させる即効性には乏しく、長期的に安定した治療効果を目指す方法といえます。免疫チェックポイント阻害薬といった薬物療法と併用することで、さらに効果を高めることが期待できます。
免疫細胞治療は、膵臓がんや消化器がん、婦人科がんなど幅広いがん種に適用されますが、進行が非常に早いがんや大きな腫瘍に対しては、単独では十分な効果が得られない場合があり、他の治療法と組み合わせて行うことが重要です。治療効果を最大化するためには、患者の体調管理も重要であり、免疫力を十分に引き出せるような健康状態を保つ必要があります。
免疫細胞治療などの再生医療は今後さらに発展が期待される分野ですが、まだ課題があり、特に個々の患者から採取する細胞の質のばらつきや、治療効果を証明するための臨床試験の困難さが挙げられます。日本では、条件付き承認制度などの仕組みによって治療の早期実用化が進められていますが、さらなる研究と制度の整備が求められます。このような取り組みによって、免疫細胞治療がより多くの患者にとって現実的な選択肢となることが期待されます。
2023年7月にBS朝日にて放送された、医TVスペシャル「健康寿命と免疫の視点から~がん治療における免疫の可能性を探る~」では、長寿と免疫、がんと免疫の関係が取り上げられ、110歳を超える長寿の方(スーパーセンチナリアン)にはある特殊な免疫細胞が増えていることがわかったことが紹介されました。
一般的に歳をとると免疫力が下がって、がんや感染症などで亡くなる方もたくさんおられますが、スーパーセンチナリアンは、こうしたがんや感染症を回避して長く健康な方が多いとのこと。
番組では、免疫チェックポイント阻害薬と免疫細胞治療を併用する臨床研究が進められていることも紹介されており、がん治療において免疫の果たす役割は益々高まっています。
動画が公開されています。→こちら(医TVサイト)
がん免疫細胞治療を行う瀬田クリニック東京、および北海道、広島、福岡の施設で、 免疫チェックポイント阻害剤(オプジーボ、キイトルーダ、テセントリク)の治療後の方を対象とした、免疫細胞治療の臨床研究が実施されています。
対象となるのは、現在がん治療を行っている方で、以下に当てはまる方となっています。
- 免疫チェックポイント阻害剤を3ヶ月以上投与しており、標準治療が終了している、または終了予定の方
- 免疫チェックポイント阻害剤の最終投与日から100日以内に免疫細胞治療を開始出来る方
- 本研究の参加後も主治医におかかり頂ける方
治療費:無償
なお、臨床研究の詳細な情報はこちらからご覧いただけます。
遅ればせながら、明けましておめでとうございます。
がんと闘っている全ての患者さん、ご家族の皆様にとって、明るい1年になりますことを願います。
今回は、抗がん剤と免疫チェックポイント阻害薬で効果が現れなかった患者さんが、直後に免疫細胞治療を受けて高い効果が出た、という事例が報告されており、ご紹介したいと思います。
患者さんは、4期(ステージⅣ)の進行腎盂がんの70代の女性。
腎盂とは腎臓から膀胱へ尿を運ぶ管状の臓器で、尿管と繋がっています。腎盂がんは、他の多くのがんと同じく、早期では目立った自覚症状は出ないことが多く、がんが大きくなってくると血尿などの症状が出てきます。この患者さんも血尿が見られ、受診したところがんが見つかったそうです。
既に肝臓や肺に転移があって手術ができない状態だったため、抗がん剤(化学療法)と免疫チェックポイント阻害薬のひとつであるキイトルーダで治療を行いましたが効果がなく治療は中止に。しかしその後、免疫細胞治療を行ったところ著効し、肝転移、腎盂ともにがんが縮小したそうです。
これは免疫チェックポイント阻害薬のあと、まもなくして免疫細胞治療を開始したことが良かったのではないかと考えられるそうです。

免疫は、がんの発症を防ぐだけでなく、治療を行う上でも非常に重要ということが常識となりました。そして免疫チェックポイント阻害薬という、体の免疫力を利用するがん治療薬が登場して10年弱。今ではさまざまながんの治療で使われるようになっています。
ただ、免疫の仕組みは複雑なので、有効に働くためにさまざまなポイントがあり、残念ながら免疫チェックポイント阻害薬のみで効果が得られない患者さんもいます。
免疫チェックポイント阻害薬は、免疫が働きにくくなっているブレーキを外す薬です。
上記のケースでは、それだけでは上手く免疫を働かせることが出来なかったものの、免疫チェックポイント阻害薬の効果が残っているうちに、免疫細胞治療の効果が加わったのが良かった可能性があります。
こうした組み合わせの治療効果を明らかにするための臨床研究が行われており、現在研究参加いただける患者さんの募集が行われています(治療費は無償)。
▼臨床研究を行っている医療機関のページ
免疫チェックポイント阻害剤の治療後の方を対象に、免疫細胞療法(アルファ・ベータT細胞療法)の安全性および有効性を確認する臨床研究
【参考】
・国立がん研究センター東病院 腎盂・尿管がん
https://www.ncc.go.jp/jp/ncce/clinic/urology/070/010/030/20210517153038.html

7/22に、京都大学と近畿大学の研究グループが、がんの免疫療法「免疫チェックポイント阻害薬」の効果を予測できるプログラムを開発した、というニュースがありました。
免疫チェックポイント阻害薬はがん免疫療法のひとつで、がんによって抑えられている免疫本来の働きを復活させる薬です。
従来の抗がん剤や分子標的薬とは違う作用機序で、そうした薬が効かないがんでも効果が期待できるとして、さまざまながんで承認され、使用されています。当ブログをご覧になっている患者さんも、ニボルマブ(オプジーボ®)やペムブロリズマブ(キイトルーダ®)といった免疫チェックポイント阻害薬が使われていることをご存じだったり、実際に使われた方もいらっしゃると思います。
ただし、免疫チェックポイント阻害薬も実際に効果が得られる患者さんは2〜3割で、効くどうかの事前予測も難しいという課題もありました。
今回、研究グループは1万例のDNAデータを分析して、固形がん(血液がん以外のがん)を8パターンに分類し、その中で免疫チェックポイント阻害薬が効きやすいがんが分かったそうです。
がんは、細胞の遺伝子に変異が起こることで発症する病気です。
こうした遺伝子の変異が多いがんは免疫療法が効きやすいことが分かっているので、これまでの効果予測は、主に遺伝子変異の量を調べて予測していました。ただし、こうした遺伝子変異の量が多くても効果がない場合や、逆に少なくても効果が出る場合があり、その精度が高くないことが課題でした。
そこで、1万例のDNAデータを分析して遺伝子変異の量ではなく、原因による特徴で分類したところ、遺伝子の変異が起こる原因がタバコや紫外線などの外的なものだと免疫チェックポイント阻害薬が効きやすく、加齢のような内的な要因だと効きにくいことが分かったそうです。これは臓器の種類は関係ありませんでした。
この、免疫チェックポイント阻害薬の効きやすい遺伝子変異の原因のタイプは全体の3分の1を占めるとのことなので、もともと知られていた「効果が現れるのは2,3割」とも合致している印象です。
(研究論文は、がん免疫領域の科学雑誌Journal for ImmunoTherapy of Cancerに掲載)
免疫チェックポイント阻害薬は薬剤費も高額であり、無駄な治療を行わずに済む意味でも事前に効果予測ができるのは有益なことで、今後は実際の治療現場で使えるようになることが期待されます。
とはいえ、効果が期待できないと判定された患者さんにとっては、有効な手立てがなければ引き続き課題です。
免疫チェックポイント阻害薬を行うも効果が出なかった進行がんの患者さんが、その後に単独で免疫細胞治療を行って著しい効果が出た事例が最近ありました。次回はその話を紹介させていただこうと思います。
【参考】
https://newscast.jp/news/2142996
現在、代表的ながん治療法として、外科療法(手術)と放射線療法、抗がん剤などの薬物療法、免疫療法の4種類があります。
この中で、免疫療法は比較的新しい治療として、最近知られてきたように思います。しかし実は古くから研究され、一部の治療法は以前から保険適用となっているものもあります。
がん免疫療法の歴史を振り返るとともに、現在の免疫療法をご紹介します。
がん免疫療法の歴史
がん免疫療法が始まったのは、実は100年も前の話だそうです。
ウィリアム・コーリーという外科医師は、19世紀末、肉腫の患者さんのがんが細菌に感染した後に縮小したのを目撃して、細菌の感染により患者自身の体ががんを抑え込むようになるという仮説を立て、死滅させた細菌を腫瘍内に注入するというがん治療を始めました。この治療によりがんの縮小が持続し、また消失することもあったそうです。これががん免疫療法の先駆けとされています(※1)。
当時は免疫についてほとんど明らかになっておらず、コーリー医師自身もなぜ細菌の死がいが、がんを消滅させたのか分かりませんでした。治療法の原理が不明だったこと、そして同時期にキュリー夫人による放射線の発見により放射線療法が発展したことで、免疫療法の開発は忘れ去られてしまったそうです。
再び免疫療法が注目され始めたのは1970年代でした。BCGをはじめとする細菌製剤が、がん治療薬として認可されたのです。BCGはもともと結核予防のためのワクチンとして開発され、9つの針のある管針で2回肩の皮膚に接種します。子供の頃に接種を受けた方は、肩に9つの点の接種跡が残っている方もいらっしゃると思います。
当時はまだ、細菌製剤ががんに効く仕組みは十分に明らかになっていませんでしたが、細菌がもつ成分が食細胞にある特定の受容体に結合して、がんに作用したと考えられています。食細胞とは、体外から侵入した異物を食べて排除したり、食べた異物の情報をほかの細胞へ受け渡したりする免疫細胞の一種です。その後、だんだんと免疫の仕組みが明らかになり、BCGは当時膀胱がんの標準的な治療法となりました(※2)。
副作用を解消するために開発された免疫細胞治療
初期の免疫療法は、免疫を刺激し、活性化させて異物であるがん細胞を排除するように働きかける治療法です。免疫を刺激するのに使われたものが、細菌やキノコに含まれる成分です。
また、免疫が働く時に放出されるサイトカインと呼ばれる物質は、免疫の主要な細胞であるT細胞を増殖させて免疫を増強します。そのため、サイトカインもがん治療薬として応用されました。しかしサイトカインや細菌成分によるがん治療薬は、副作用が問題でした。そこで新しく考え出されたのが、免疫細胞治療です。
免疫細胞治療は、がん患者さんから採血し、血液中から取り出した免疫細胞を体外でサイトカインにより刺激して増殖させ、副作用のもとになるサイトカインを取り除いてから再び体内に戻すという治療法です。サイトカインは体内に入らないため、副作用も問題になりません。そして2010年には、アメリカで初めて免疫細胞治療が前立腺がんの治療として承認されました。
樹状細胞ワクチン療法とは?
免疫細胞治療のひとつとして、近年注目されているのが樹状細胞ワクチン療法です。
樹状細胞とは免疫細胞の1種で、体に害となる異物の情報を読み取って、攻撃役であるT細胞へと伝えます。樹状細胞から情報を受け取ったT細胞は抗体を産生したり、異物を直接攻撃して排除したりします。
樹状細胞ワクチン療法では、体外に取り出した患者さんの樹状細胞に、がんの目印となるタンパク質をわざと取り込ませることで標的を覚え込ませ、それを体内に戻すことで、体の中でT細胞への指令をより強力にする仕組みの治療です。
最新の樹状細胞ワクチン療法としては、患者さんのがんを遺伝子解析して、その患者さんだけの目印を作って樹状細胞に取り込ませる「ネオアンチゲン樹状細胞ワクチン療法」が研究され、臨床研究も行われているそうです。
今後、治療実績が増えれば、新しいがん治療として普及するかもしれません。
【参考文献】
※1)Nature ダイジェスト Vol. 12 No. 2 | doi : 10.1038/ndigest.2015.150230
※2)後藤重則医師, 家族を守る免疫入門, KAWADE夢文庫,2020.

日本人の2人に1人が一生のうちにがんと診断され、男性は4人に1人、女性は6人に1人ががんで亡くなるそうです(※1)。がんは日本人の死因トップ(※2)でもあり、「がんは怖い病気」とのイメージがあります。
なぜがんが発生するのか、その原因やがん細胞から体を守る仕組みについて調べてみました。
がんの原因は遺伝子の異常
がんは、体内に発生したがん細胞が増えて塊になることで正常な細胞を侵食し、臓器が正しく機能できなくなることで死に至る病気です。
そもそもがん細胞が発生するのは、正常な細胞の中にある、体の設計図といえる遺伝子に異常が起こることが原因といわれています。
通常、細胞は1つから2つ、2つから4つと分裂してどんどん新しい細胞を作っています。私たちの体は約38兆個もの細胞からできているといわれており、1日で1%の古い細胞が死に、その分新しい細胞を産み出しているとされています(※3)。
そうした過程で、何らかの理由で細胞の遺伝子に異常が生じ、その異常な細胞が分裂して増えてしまうことで、がんになるといわれています。
がん細胞が厄介なワケ
正常な細胞は、一定回数分裂したら自動的に死滅するようにプログラムされています。そのため、細胞が増えすぎてしまうことはありません。
しかし、がん細胞には正常な細胞のように制御機能がなく、際限なく分裂し、増えていきます。増えすぎたがん細胞は、塊となってさらに大きくなっていきます。
がん細胞が厄介な理由は、浸潤と転移と呼ばれる現象があるためです。浸潤とは、がん細胞が正常な細胞の間に広がって、自分の陣地を広げることです。がん細胞が浸潤すると、その臓器は正常に機能できなくなります。
転移とは、血管やリンパ管にがん細胞が侵入し、血液やリンパ液にのって全身へ流れていき、最初にがん細胞が発生した場所から離れた場所に移動することです。正常な細胞は大腸の細胞なら大腸で、胃の細胞なら胃でしか増殖できませんが、がん細胞は全身どこでも増殖できてしまうので厄介なのです。
免疫ががん細胞の芽を摘んでいる
がん細胞は、遺伝子に病的な異常が生じることで発生しまいます。しかし、遺伝子に異常が起こるとただちにがん細胞ができるわけではありません。私たちの体にはこの遺伝子の異常を修復する機能が備わっています。細胞の遺伝子に異常が生じた場合、体は自動的に異常を修復して正常に戻します。
ただし、こうした異常は日々膨大な回数起こっているとされていて、すべての異常が修復されるわけではありません。なかには修復されないままになってしまうこともあるそうです。そうなったときは「免疫」の出番です。
異常な遺伝子を持った細胞は、正常な細胞にはない異常なタンパク質を作ります。私たちの体に備わった免疫は、この異常なタンパク質を目印として、正常な細胞でないことを見分けて攻撃し、がん細胞の芽を摘んで体を守ってくれているのです。
免疫が、どのようにしてがん細胞などから体を守っているかは、以前のブログにも書きました。
→「免疫はどうやって私たちの体を守っている?」
がん細胞が発生してしまったら、がんが進行していずれ死に至ると思われがちです。しかし、体内では自分でも気づかないうちに免疫細胞ががん細胞を見つけ、排除してくれています。だからこそ、がんに対抗するには免疫の力が重要なのです。
【参考文献】
※1)国立研究開発法人国立がん研究センター「最新がん統計」
https://ganjoho.jp/reg_stat/statistics/stat/summary.html
※2)厚生労働省「死因順位(第5位まで)別にみた年齢階級・性別死亡数・死亡率(人口10万対)・構成割合」
https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/suii09/deth8.html
※3)東京都福祉保健局「がんって何?」
https://www.fukushihoken.metro.tokyo.lg.jp/iryo/iryo_hoken/gan_portal/research/about.html
後藤重則医師「家族を守る免疫入門(KADOKAWA夢文庫)」2020.
前のページ »












